近日,斯坦福大学医学院Tony Wyss-Coray团队在Science Translational Medicine期刊上发表The CD22-IGF2R interaction is a therapeutic target for microglial lysosome dysfunction in Niemann-Pick type C 的文章,发现在NPC患者脑脊液中增加的可溶性CD22(sCD22),在人脑中的少突胶质细胞上表达,并与小胶质细胞上的唾液酸依赖性配体结合。使用无偏倚的遗传和蛋白质组学筛选,鉴定到胰岛素样生长因子2受体(IGF2R)是sCD22的结合对象。进一步研究发现sCD22停靠在甘露糖6-磷酸结合域附近,破坏了溶酶体蛋白的运输。使用CD22阻断抗体干扰sCD22-IGF2R相互作用可改善人NPC1突变体诱导的多能干细胞衍生的小胶质细胞样细胞的溶酶体功能障碍,而不会在体外伤害少突胶质细胞。研究结果提供了一种候选的小胶质细胞导向的免疫疗法来治疗NPC。

作者首先通过挖掘数据库、人体组织原位杂交以及原代人皮层组织流式分析,确定了CD22主要是在少突胶质细胞上表达,也是脑脊液中可溶性CD22(sCD22)的主要来源。其次,研究了sCD22是否可能与人类中枢神经系统(CNS)中的配体结合以调节大脑功能,发现ST6GAL1,一种唾液酸转移酶,在CNS中的小胶质细胞中特别富集,可能是sCD22的目标,因此作者提出sCD22可以通过结合小胶质细胞上的唾液酸配体,以调节小胶质细胞功能的假设。
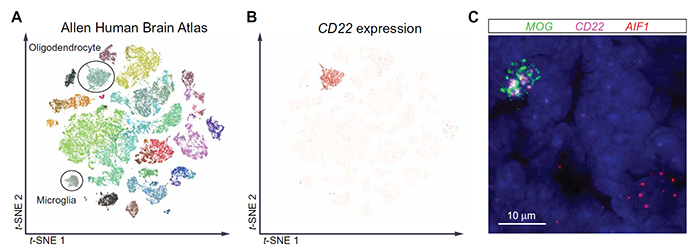
图1. CD22几乎完全由少突胶质细胞表达
进一步,作者鉴定了小胶质细胞上的sCD22结合伴侣,使用人骨髓细胞系U937(之前曾用于模拟人类小胶质细胞并表达CD22配体),进行全基因组CRISPR-Cas9筛选,也对sCD22的直接结合配体进行亲和纯化、液相色谱-质谱分析。结果鉴定到胰岛素样生长因子2受体(IGF2R),也称为阳离子非依赖性甘露糖6-磷酸(M6P)受体。因此,IGF2R是多种筛选方法同时鉴定到的sCD22结合伴侣。此外,使用电泳迁移率变动分析和定量生物膜层干涉测量法,作者证实CD22和IGF2R之间的生物物理相互作用具有微摩尔亲和力,与CD22的天然聚糖配体相当,CD22损害了IGF2R依赖性溶酶体运输。
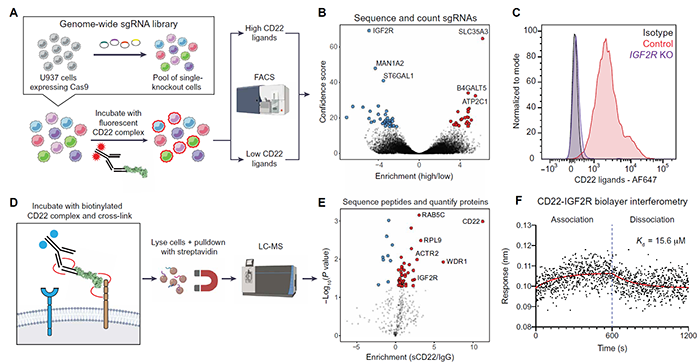
图2 遗传和蛋白质组学筛选阐明CD22-IGF2R相互作用
在确定sCD22损害IGF2R依赖性溶酶体运输后,作者意欲评估sCD22阻断在NPC中的治疗潜力。首先作者制备、筛选获得了三种CD22单克隆抗体,它们可以特异性地与CD22结合以及对sCD22有效阻断,对sCD22与IGF2R敲除细胞的结合没有影响,表明它们对CD22-IGF2R相互作用的特异性破坏。进一步表征三种候选单抗的生物物理特性,选择了M42克隆作为主要候选者,因为M42克隆可以有效阻断CD22-IGF2R相互作用和修复U937细胞中的NPC2溶酶体运输。结果发现阻断CD22降低了与溶酶体转运相关基因的表达,增加了与脂滴定位相关基因的表达,这些发现表征了针对NPC的小胶质细胞定向免疫疗法的动力学、功能和原理验证功效。此外,作者也考虑到阻断膜结合CD22对少突胶质细胞的潜在靶向毒性可能会限制其临床安全性,经过评估发现抗CD22治疗不影响少突胶质细胞增殖或成熟,这些结果减轻了使用CD22抗体治疗NPC的靶向毒性问题。
综上所述,本文揭示了sCD22在人脑中的来源、目标和功能。发现sCD22是一种少突胶质细胞衍生的蛋白质,可与小胶质细胞上的IGF2R结合并损害溶酶体功能。阻断CD22可改善NPC1突变体中的溶酶体功能障碍,并且不会在体外影响少突胶质细胞的增殖或成熟。研究结果提供了一种候选的小胶质细胞导向的免疫疗法来治疗NPC。













